KBSI-KAIST, 알츠하이머병 유발하는 독성 단백질 발굴 KBSI 이영호 박사, KAIST 임미희 교수 등 공동연구팀, ‘아밀로이드 전구체 C 말단 절단체’(응집체 형성 및 독성 촉진제)가 알츠하이머병 병리 인자인 아밀로이드-베타와 직접 결합해 응집체 형성 촉진 및 독성 증가를 유발함을 발견 기존에 발견되지 않은 알츠하이머병의 새 바이오마커 및 치료타깃 제안
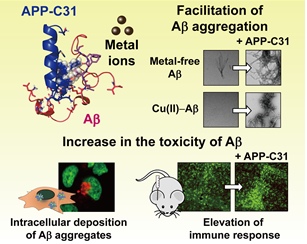
그림1. 아밀로이드 전구체 C 말단 절단체(APP-C31) 단백질이 알츠하이머 병리 인자들의 기능에 미치는 영향
알츠하이머병은 가장 대표적인 신경퇴행성 질환으로, 기억력 감퇴와 인지 능력 저하를 유발한다. 알츠하이머병의 발병 인구가 급속히 증가하고 있으나, 현재까지 발병 원인이 명확히 밝혀진 바 없고, 이에 따라 효과적인 치료제 개발 또한 굉장히 더디게 진행되고 있다.
한국기초과학지원연구원(원장 양성광, 이하 KBSI)은 바이오융합연구부 이영호 박사 연구팀이 KAIST(총장 이광형) 화학과 임미희 교수(금속신경단백질연구단 단장), 화학과 백무현 교수, 의과학대학원 한진주 교수 연구팀과 공동으로 알츠하이머병 유발인자의 독성을 촉진하는 세포 내 단백질을 발굴, 알츠하이머병과 관련된 새 병리적 네트워크를 제시했다고 20일 밝혔다.
알츠하이머병 환자들의 뇌에서 대표적으로 나타나는 병리적 현상은 노인성 반점 축적이다. 노인성 반점의 주된 구성분은 아밀로이드-베타 펩타이드로인 응집체로, 세포 내 물질들과 결합해 세포 손상을 유발한다. 따라서, 이들 응집체와 세포 사멸 간의 상관관계가 활발히 연구되고 있다. 그러나, 아밀로이드-베타와 세포 사멸 유발 인자들 간의 직접적인 상호작용에 관해서는 아직 많은 부분이 밝혀진 바 없다.
최근 미국 FDA에서 승인한 알츠하이머병 신약은 노인성 반점을 나타내는 아밀로이드-베타 펩타이드의 응집체 세포 손상을 주요 타깃으로 하여 개발됐다. 하지만, 제한된 사용 여부(특히, 부작용)로 그 신약 개발의 방향 전환 및 개선이 필요함을 연구자들은 절실히 느끼고 있다.
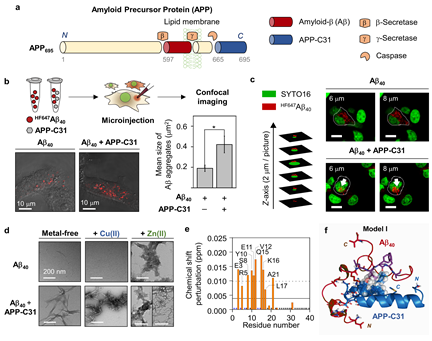
그림2. 아밀로이드 전구체 C 말단 절단체(APP-C31)로 인한 아밀로이드-베타 및 금속-아밀로이드-베타 섬유화 촉진_ a) 아밀로이드 전구체 단백질 내에서 생성되는 아밀로이드-베타 및 APP-C31 단백질, b) 세포 내 미세주입을 통해 관찰한 APP-C31 유무에 따른 아밀로이드 응집 변화, c) APP-C31로 인한 아밀로이드-베타 응집체의 핵 주변 축적 현상, d) APP-C31가 존재함에 따라 가속화된 아밀로이드-베타 및 금속-아밀로이드-베타 섬유체 형성, e) 아밀로이드-베타 내 APP-C31와의 상호작용 영역, f) 아밀로이드-베타-APP-C31 결합 예측 구조
공동연구팀은 알츠하이머병에서 과발현되며 원인 미상의 신경세포 사멸을 유발하는 ‘아밀로이드 전구체 C 말단 절단체’ 단백질이 아밀로이드-베타 및 금속-아밀로이드-베타 복합체와 결합해 응집을 촉진하고, 독성 촉진제 역할을 함을 세계 최초로 증명하는 연구 내용을 발표했다.
본 연구 결과는 아밀로이드 전구체 C 말단 절단체 자체 또는 아밀로이드-베타가 결합한 복합체가 새로운 알츠하이머병의 새로운 바이오마커로 작용할 수 있고, 또한 그들이 새로운 신약개발 타깃이 될 수 있음을 제시하고 있다.
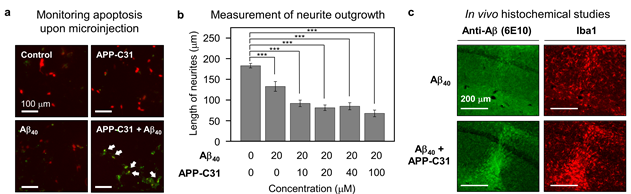
그림3. 아밀로이드 전구체 C 말단 절단체(APP-C31)로 인한 아밀로이드-베타의 독성 증대 효과_APP-C31과 아밀로이드-베타 간의 상호작용으로 인한 a) 세포사멸현상 발현, b) 신경돌기감소 및 신경변성, c) 염증 반응 증가
이번 연구는 세포 내 단백질 미세주입 기술을 통해 세포 안에서 아밀로이드 전구체 C 말단 절단체가 아밀로이드-베타 응집 촉진에 미치는 역할을 확인했다. 더 나아가, 뉴런 세포 및 설치류의 뇌에서 아밀로이드-베타와 관련된 세포 사멸, 뉴런 손상, 염증 반응이 아밀로이드 전구체 C 말단 절단체에 의해 더욱 증가하는 현상을 최초로 확인해 세계적으로 주목받고 있다.

사진. 공동연구자 사진. (왼쪽부터) KAIST 임미희 교수(공동교신저자), 백무현 교수(공동교신저자), 한진주 교수(공동교신저자), KBSI 이영호 책임연구원(공동교신저자)
KAIST 임미희 교수는 “이번 연구 결과는 알츠하이머병에서 기존에 알려지지 않은 생체 내 아밀로이드 베타 응집 및 독성 촉진제 발굴에 큰 의의가 있다”며, “이번 연구 성과는 새로운 바이오마커 및 치료타깃을 제안하고 있다”고 밝혔다.
KBSI 이영호 박사는 “알츠하이머병이 유발되는 다양한 경로 중 하나의 중요한 단백질 응집 기반 질환 유발 경로를 다학제적인 접근 방법으로 규명할 수 있었다”며, “생체 내 다양한 환경 조건을 고려한 단백질 응집 융합연구가 질환 극복의 핵심이 될 것”이라고 밝혔다.
본 연구결과는 KBSI 주요사업, 한국연구재단 기초연구사업(특히, 리더연구), 국가과학기술연구회, IBS 및 KAIST의 지원을 받아 수행됐으며, 국제 저명 학술지인 ‘Advanced Science’誌에[논문명: APP-C31: An Intracellular Promoter of Both Metal-Free and Metal-Bound Amyloid-β40 Aggregation and Toxicity in Alzheimer’s Disease, IF=15.1, KAIST 남은주(제1저자), 임미희(공동교신저자), 백무현(공동교신저자), 한진주(공동교신저자), KBSI 이영호(공동교신저자)]에 11월 10일 게재됐다. | 









